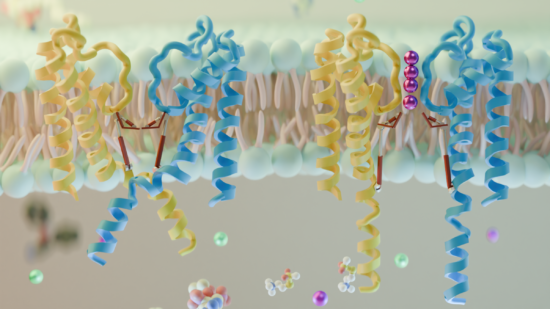
Mediante el uso de modelos tridimensionales, investigadores lograron conocer más sobre cómo operan estos canales que son cruciales para regular las señales eléctricas en las células, aportando con ello al desarrollo de tratamientos para condiciones como arritmias cardíacas, hipertensión y diabetes, entre otras.
Si imaginamos nuestro cuerpo como una gran ciudad, las células serías las casas y edificios que requieren energía, agua y muchas otras cosas, como aire acondicionado para funcionar bien, manteniendo por ejemplo la temperatura adecuada. Un elemento esencial en esta tarea es la función que cumple el potasio, que se encarga de mantener el equilibrio dentro de cada “célula” o “casas” en este ejemplo.
Es el potasio el que en definitiva asegura que las células puedan comunicarse correctamente y que las membranas celulares, igual que las puertas en una casa se puedan abrir o cerrar según se requiera. Por el contrario, si el potasio no está regulado, no funcionarán bien los músculos y el corazón, lo cual puede generar sentir debilitamiento o incluso una complicación de gravedad.
En relación a este tema, es que un reciente estudio publicado en la revista Nature Communications, reveló importantes hallazgos sobre el funcionamiento de un tipo específico de canal de potasio en el cuerpo humano. El Dr. Mauricio Bedoya Tabares, investigador del Centro de Investigación en Estudios Avanzados (CIEAM) de la Universidad Católica del Maule (UCM), desempeñó un papel clave en esta colaboración internacional al desarrollar modelos tridimensionales que sirvieron de guía en parte del trabajo experimental.

Dicho estudio se centró en un canal de potasio llamado TALK-2, que se encuentra en varios órganos, incluyendo el páncreas, el corazón y el cerebro. “Los canales de potasio son cruciales para regular las señales eléctricas en las células. Comprender cómo funcionan es esencial para desarrollar tratamientos para condiciones como arritmias cardíacas y diabetes”, indicó el doctor Bedoya.
El estudio fue liderado por el Dr. Marcus Schewe y el Dr. Thomas Baukrowitz de la Universidad de Kiel y el Dr. Niels Decher de la Universidad de Marburg.
Los modelos 3D de la estructura proteica del canal TALK-2 desarrollados por el investigador del CIEAM UCM, resultaron fundamentales para ayudar al equipo de investigación a identificar qué partes del canal debían ser objeto de sus experimentos. “Mediante el uso de estos modelos, se pudo señalar áreas específicas para modificar mediante mutagénesis dirigida, lo que condujo a descubrimientos sobre cómo el canal se abre y se cierra para controlar el flujo de potasio a través de las células”, explicó.
«Nuestros modelos 3D proporcionaron una guía que permitió al equipo realizar cambios precisos en la estructura del canal y observar los efectos», dijo el Dr. Bedoya. «Este enfoque ayudó a descubrir nuevos detalles sobre los intrincados mecanismos que controlan la actividad del canal TALK-2», agregó.
Nuevas perspectivas
El estudio reveló que TALK-2 tiene dos «compuertas» que trabajan juntas para regular el flujo de potasio. Este sistema de doble compuerta permite que el canal responda a diferentes estímulos, incluyendo cambios en el voltaje y los niveles de acidez. Los hallazgos proporcionan nuevas perspectivas sobre cómo funcionan estos importantes componentes celulares y esto abre nuevas posibilidades para poder controlarlos y diseñar nuevos fármacos.
Esta investigación colaborativa, que involucra a científicos de Alemania, Estados Unidos y Chile, demuestra el poder de combinar modelado computacional con técnicas experimentales para avanzar en nuestra comprensión de los procesos biológicos fundamentales y en el diseño de nuevos medicamentos.
El estudio completo, titulado «Ion occupancy of the selectivity filter controls opening of a cytoplasmic gate in the K2P channel TALK-2″, está disponible en el último número de la revista Nature Communications: https://doi.org/10.1038/s41467-024-51812-w
Este avance permitirá el desarrollo de nuevos fármacos orientados por ejemplo a la regulación de ritmo cardiaco, diabetes, hipertensión, entre otras.